Кошель М.С., Габриелян Н.В., С.А.Парфейников
Организационно-функциональные модели регулирования фармацевтической деятельности в России и Армении
В данной статье рассмотрены организационно функциональные модели регулирования фармацевтической деятельности в России и Армении, проведена оценка их экономической эффективности.
Регулирующее воздействие может быть прямым и косвенным.[1] В качестве примеров прямого регулирования можно назвать:
- установление требований, предъявляемых к определенным субъектам;
- введение запретов на занятие отдельными видами деятельности или ее отдельные проявления;
- применение государством санкций и мер ответственности;
- создание, реорганизация и ликвидация субъектов, занимающихся отдельными видами деятельности;
- заключение договоров с отдельными субъектами на оказание определенного объема услуг, поставку продукции, лекарственных средств и др.
Косвенные методы предполагают регулирующее воздействие на субъекты, в том числе потенциальные, посредством установления режимов наибольшего благоприятствования, льготного налогообложения.
- создание и поддержание системы органов, осуществляющих реализацию проводимой политики в рассматриваемой сфере;
- финансирование фармацевтической деятельности;
- государственное регулирование фармацевтического образования и науки;
- совершенствование косвенных методов регулирования, стимулирования развития фармацевтического рынка;
- стимулирование инноваций на фармацевтическом рынке;
- государственный надзор;
Государственное управление осуществляется специально создаваемыми органами. На структуру аппарата управления влияют многие объективные и субъективные факторы. Наиболее значимыми из них являются содержание управленческой деятельности, совокупность основных функций органа, аппарата.
В России функционируют органы исполнительной власти, различающиеся по уровню их нахождения в структуре исполнительной власти, роли, сферам и отраслям управления, компетенции. Систему органов исполнительной власти в России возглавляет Правительство РФ.
Федеральное министерство – это федеральный орган исполнительной власти, осуществляющий функции по выработке государственной политики и нормативно-правовому регулированию в установленной законодательством сфере деятельности.
Для эффективного обеспечения полномочий в социальной сфере, обеспечения законности, прав и свобод граждан создано Министерство здравоохранения и социального развития РФ. Оно является федеральным органом исполнительной власти.
Современное нормативно-правовое поле в сфере обращения лекарственных средств формируется в течение последних 10 лет (рис. 1).[2]
Фармацевтический рынок является социально значимым рынком, что приводит к необходимости активной реализации на нем концепции развития конкурентной предпринимательской среды при условии эффективного государственного регулирования и поддержки. Совершенствование регулирования приведет к развитию честной конкуренции на внутреннем фармацевтическом рынке, позволит создать на рынке товаров и услуг позитивный имидж предприятий-производителей и дистрибьюторов, повысить их социальную ответственность, приобрести доверие клиентов, партнеров и потребителей, что скажется на повышении качества жизни, улучшении демографической ситуации и социальных условий в стране в целом.[3]
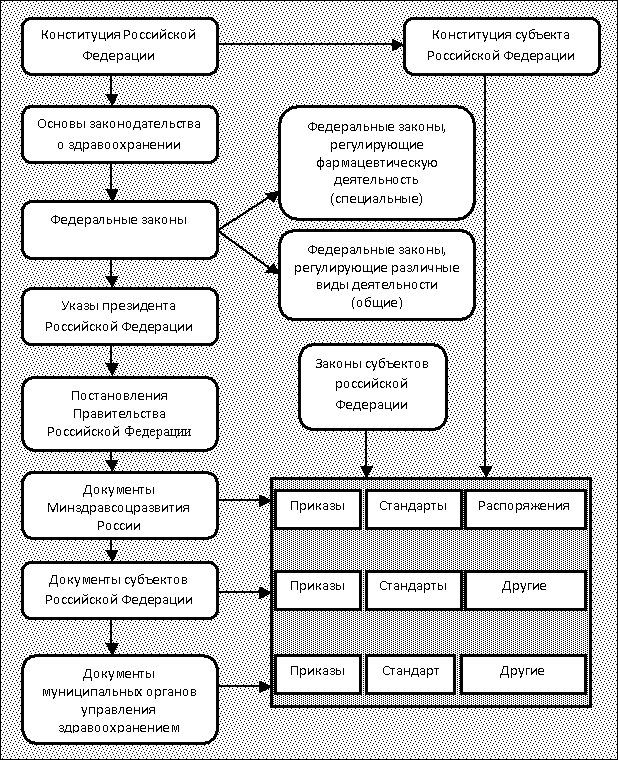

Рис. 1. Нормативно-правовое поле здравоохранения и фармацевтической службы
Специфика фармацевтического рынка определяется необходимостью государственного регулирования, охватывающего различные аспекты обращения ЛС; существованием специализированных каналов реализации ЛС и специализированных субъектов рынка; особенностями формирования спроса на фармацевтическую продукцию (участие государства в финансировании значительной части потребляемых ЛС; действие специфического демографического фактора – заболеваемости; необходимость соблюдения особых этических норм при продвижении ЛС).
Специфика российского фармацевтического рынка также имеет свои отличия, заключающиеся в низкой мотивации врачей на результат; отсутствии реальной системы льгот на медикаменты; неэффективности страховой медицины; недобросовестной конкуренции; нарушении законодательства; низкой медицинской культуре населения. В связи с этим очевидна необходимость усиления роли государства, как в организации самого рынка, в его мониторинге, так и в регулировании организационно-экономических отношений и социальной защите потребителей.
Основной целью государственной политики РФ по развитию национальной фармацевтики на период до 2020 года является создание условий для ее перехода на инновационную модель развития, подразумевающую, что государство возьмет на себя основную нагрузку по запуску инновационного цикла с последующим нарастающим рефинансированием исследований и разработок.
В регионах органы управления фармацевтической деятельностью имеют разные названия (Министерство здравоохранения, Комитет по здравоохранению, Департамент охраны здоровья и т. п.). Системе органов управления свойственно двойное подчинение. Это значит, что по общим вопросам деятельности органы управления фармацевтической деятельностью подчиняются правительству территорий, а по вопросам здравоохранения − вышестоящему (федеральному) органу управления (рис. 2).
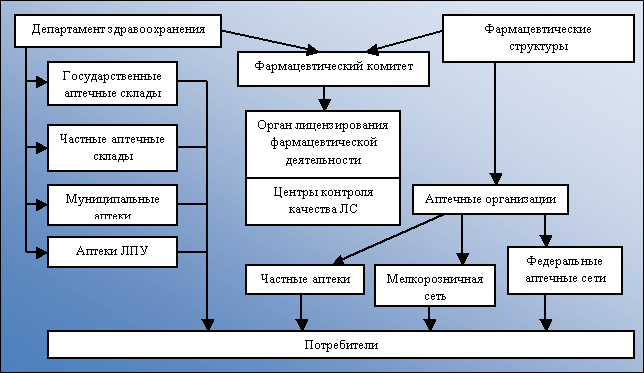

Рис. 2. Уровни управления фармацевтической деятельностью на региональном фармацевтическом рынке
В Армении, как и в других государствах содружества, после распада СССР в 90-годах, произошли значительные изменения в структуре управления, принципах организации лекарственного обеспечения населения и содержании деятельности оптового и розничного звеньев фармацевтической службы.[4]
В структуре Министерства здравоохранения Республики Армения действует – «Отдел организации фармацевтической деятельности и лекарственного обеспечения». В его функции входят:
• выдача разрешений на право ввоза или вывоза лекарственных средств и изделий медицинского назначения, которое осуществляется на основании заключения «Научного центра экспертизы лекарств и медицинских технологий» (Решение Правительства №581 от 20 сентября 2000г. и Приказ МЗ РА №662 от 10 октября 2002г. зарегистрированное в Минюсте 1 ноября 2002г.);
• предоставление лицензионному отделу министерства профессионального заключения на право занятия организацией фармацевтической деятельности, в частности, на право открытия, аптеки, аптечного киоска или фармацевтического производства;
• составление списка препаратов, закупаемых государством. Обоснование этих заказов с перечнем хронических заболеваний, при которых они используются (Решение Правительства №396 от 8 июня 1999г. и Приказ М3 РА №128 от 07.03.2001г., зарегистрированное в Минюсте 26 марта 2001г.). Согласование этого перечня с главными специалистами министерства. Предоставление этого списка в «Агентство по государственным закупам» при Министерстве финансов и экономики, организация надлежащего составления заявок на лекарственные препараты и ИМН, поступающие в Армению по линии гуманитарной помощи и благотворительности. Организация надлежащего условий хранения, учета и отпуска этих средств через базу «Республиканского центра гуманитарной помощи» при М3 РА. (Решение Правительства №631 от 14 сентября 2000г. и Решение Правительства №1432-Н от 14 октября 2004г.);
• организация и проведение фармацевтических обследований и проверок, совместно с «Научным центром экспертизами лекарства и медицинских технологий».
«Научный центр экспертизы лекарств и медицинских технологий» АОЗТ Минздрава РА который является правопреемником созданного в 1992 году «Агентства по лекарствам и медицинским технологиям М3 РА». На этот орган управления возложена ключевая роль в следующих вопросах: о разработке регулирующих документов и предоставление их в соответствующий отдел министерства; о регистрации лекарств (Решение правительства №347 от 25 апреля г.), сертификации импорта и экспорта; о рациональном применении лекарственных средств; о мониторинге побочных реакций; о осуществлении лабораторного контроля качества; о информационном обеспечении лекарственного обращении; о выдаче окончательного заключения на клинические испытания новых ЛС (Решение правительства № 63 от 24 января 2002г).
В 1992 г. Центральная аптечная база Главного аптечного управления Минздрава Республики Армения была реорганизована как отдельная хозяйственная структура, и присоединена к ГАПУ.
В 1993 г. Главное Аптечное управление Минздрава Республики Армения (ГАПУ) было переименовано в Государственное предприятие (ГП) «Армфармация», которая организовывала фармацевтическую деятельность Армении и была единственной организацией занимающейся ввозом и распределением ЛС и ИМН, кроме действующих с 1992г. двух оптовых фарморганизаций- ООО «Лиганд» и ООО «Дехабаза Ереван». ООО «Лиганд» в 1995г. прекратила свою деятельность, свою деятельность продолжает ООО «Дехабаза Ереван». В 1993г. в состав ГП «Арфармация» входили аптечное управление, центральная аптечная база, аптеки городов Ереван, Гюмри, Ванадзора и районные аптеки республики. Наряду с государственными аптеками тогда существовали и первые арендные аптеки (11 аптек в г. Ереване и 5 районных арендных аптек), которые были одним из первых приватизированных аптек Армении. Приватизация аптек началась с 1993г. и закончилась полностью в 1998г. Таким образом, можно констатировать, что в Армении все аптеки и оптовые фарморганизации являются частными.
Законодательное поле, регулирующее фармацевтическую деятельность в Республике Армения, характеризуется следующими нормативными актами;
· Конституция РА;
· Международные нормативные акты (конвенции, соглашения, договоры, протоколы и т.д. и т.п.);
· законы РА;
· решения Парламента (Национального Собрания) РА;
· решения правительства РА;
· решения Премьер Министра РА;
· ведомственные нормативные акты (приказы, решения, инструкции, инструктивные письма, уполномоченных министерств и ведомств РА), зарегистрированные в установленном порядке Минюстом РА.
Для упорядочения фармацевтического сектора правительством РА были утверждены приоритетные направления национальной лекарственной политики:
• создание адекватного законодательного поля;
• достаточный доступ к лекарствам (физический и экономический);
• рациональное применение лекарств;
• внедрение концепции основных лекарств;
• обеспечение поступления качественных лекарств на рынок.
Ключевым этапом на пути внедрения перечисленных приоритетов явилось создание в 1992 году единого регулирующего органа европейского образца - Агентства по лекарствам и медицинским технологиям Министерства здравоохранения, координирующего все основные звенья лекарственного регулирования. В соответствии с этим принципом на этот орган управления возложена ключевая роль в:
• разработке регулирующих документов;
• лицензировании аптек, производителей и оптовых поставщиков;
• регистрации лекарств, сертификации импорта и экспорта;
• рациональном применении лекарственных средств;
• мониторинге побочных реакций;
• осуществлении лабораторного контроля качества;
• информационном обеспечении лекарственного обращения.
Таким образом, основными приоритетными направлениями государственного регулирования и саморазвития рынка ЛС Республики Армения является ориентация на изучение спроса и удовлетворение потребности всех групп населения и категорий больных, в том числе социально-уязвимых, а также постоянный государственный контроль в сфере обращения ЛС.
[1] Милушин М.И., Мохов А.А. Законодательство и фармбизнес в 2011 году. М.: «Медфорум», 2011. 540 с.
[2] Управление и экономика фармации. В 4 т. Т. 1. Фармацевтическая деятельность. Организация и регулирование: учеб. Для студ. Высш. Учеб. Заведений /[И.В. Косова и др.]; под ред. Е.Е. Лоскутовой. – 2-е изд., перераб. И доп. – М.: Издательский центр «Академия», 2008. – 400 с.
[3] Кулагина, С. В. Аспекты государственного регулирования фармацевтической деятельности // Экономика и управление: проблемы и перспективы развития: Сборник научных статей по итогам международной научно-практической конференции, г. Волгоград, 15-16 ноября 2010 г.: В 2 ч. Ч. 1 / Под ред. И. Е Бельских, В. Н. Гуляихина. – Волгоград: Волгоградское научное издательство, 2010. – 212 с. – С. 99-100. – 0,1 п. л.
[4] Габриелян, Н.В. Анализ оптового рынка лекарственных препаратов на территории Российской Федерации / Габриелян Н.В. [и др.] // Материалы VII Международной научно-практической конференции / - 2011. – Вып. 39. – С. 67-69.
